Page 81 - 2018食藥署年報(中文版)
P. 81
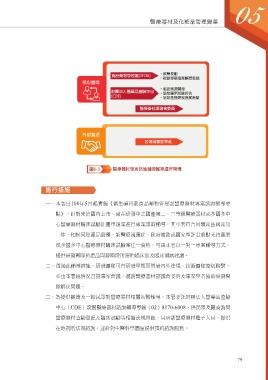
食品藥物管理署(TFDA) ‧政策規劃
‧啟動專案諮詢輔導會議
核心團隊
‧協助案源開發
財團法人醫藥品查驗中心 ‧協助臨床試驗評估
(CDE) ‧協助產品研發進度追蹤
醫療器材諮議會委員
外部資源
各領域專家學者
圖5-3 醫療器材專案諮詢輔導團隊運作架構
施行措施
一、 本署自100年5月起實施《衛生福利部食品藥物管理署醫療器材專案諮詢輔導要
點》,針對未於國內上市、尚在研發中之國產第二、三等級醫療器材或多國多中
心醫療器材臨床試驗計畫申請案進行專案諮詢輔導,其中若符合同類產品國產第
一件、相較同類產品最優、新醫療適應症、政府補助或國家型計畫重點支持產業
或多國多中心醫療器材臨床試驗案任一資格,可由本署以一對一專案輔導方式,
提供研發團隊於產品開發階段所需的臨床前及臨床測試建議。
二、 透過此輔導措施,研發團隊可自研發早期即與署內外法規、技術團隊密切聯繫,
並由本署視情況召開專案會議,邀請醫療器材諮議會委員及專家學者協助研發團
隊解決問題。
三、 為提供廠商及一般民眾對醫療器材相關初階輔導,本署委託財團法人醫藥品查驗
中心(CDE)設置醫療器材諮詢輔導專線(02)8170-6008,供民眾及廠商詢問
醫療器材查驗登記及臨床試驗等相關法規問題,另培訓醫療器材種子人員,提供
在地初階法規諮詢,並針對生醫科學園區提供預約諮詢服務。
79