
食品管
政策與
藥品管
管制藥
管理
醫療器
化粧品
國家實
檢驗
風險評
及科
國際合
兩岸
風險溝
消費
附
錄
2015 Annual Report
25
4.
生體可用率與生體相等性試驗,及溶離率曲線比對試驗(
BA/BE/Dissolution test
),係
以銜接學名藥與原開發廠藥品具相同療效及安全性之主要方法。至
103
年底,國內共有
2,008
件核發許可證藥物已於國內執行生體相等性試驗或溶離率曲線比對試驗,其中國
產藥佔
1,895
張。
(三)藥物審查機制之改革
103
年
5
月
22
日公布新藥查驗登記審查流程及時間點管控,以提升藥物審查透明度,
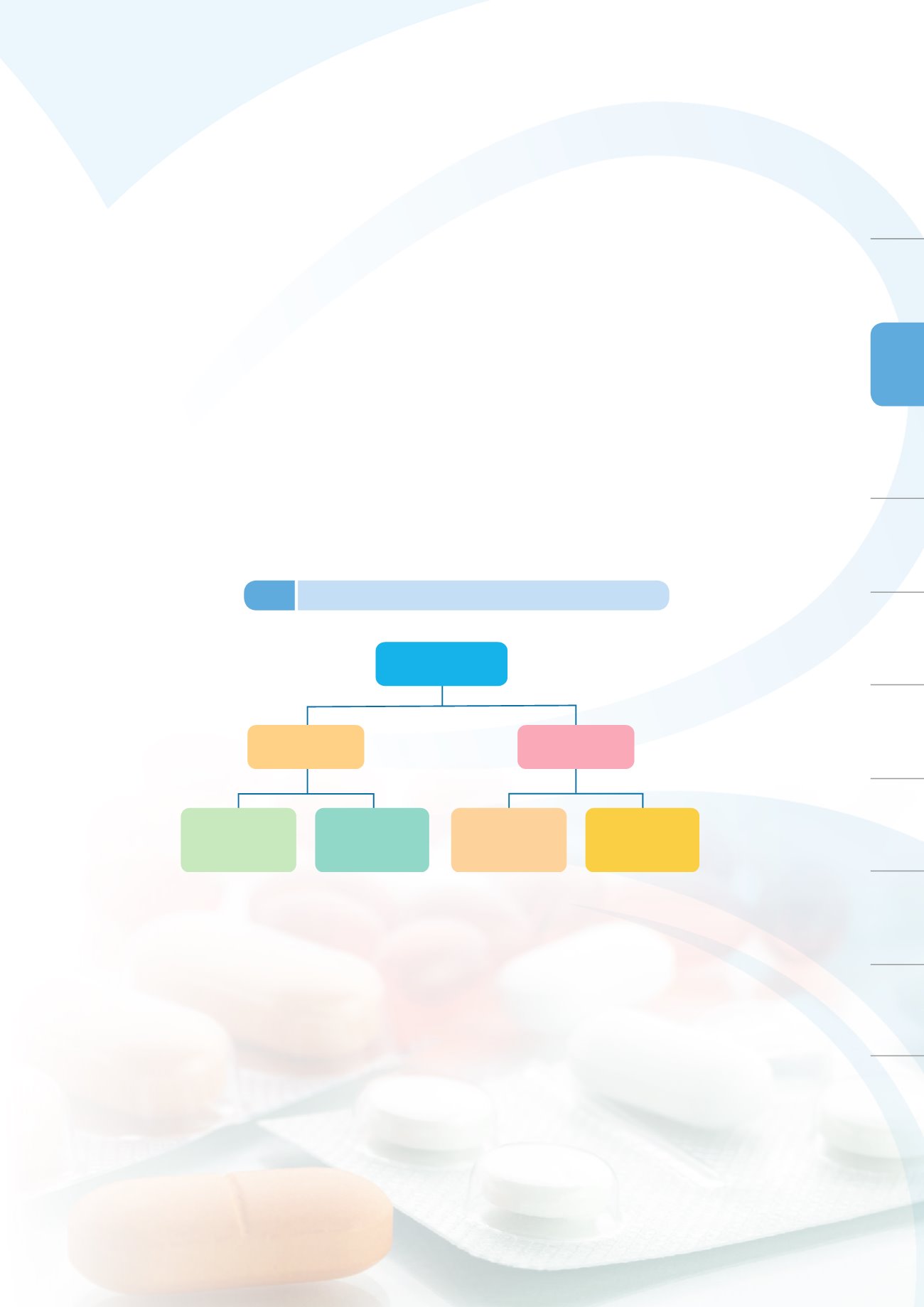
強化審查流程管控及縮短審查時程,同時參考歐、美、日等先進國家之審查機制,公
布「新藥查驗登記精簡審查程序」、「新藥查驗登記優先審查機制」及「國產創新藥品查
驗登記專案試辦計畫」(圖
3-3
),以加速新藥上市,滿足醫療迫切需求者早日治療使用。
103
年度新藥平均審查天數
288
天,共核准了
135
件新藥申請案,包括
29
件國產藥品
及
106
件輸入藥品,審查時效已優於美、歐、日等
ICH
會員國,
103
年更率先核准國產
創新之全球新成分
Nemonoxacin
太捷信膠囊,並輔導廠商規劃上市後風險管理計畫。
優先審查原則:治療嚴重疾病,且具有臨床用途之優勢者,能滿足醫療迫切需求者,得申請優先審查
精簡審查原則:美國與歐盟均核准上市之新成分新藥,無人種族群差異之考量者,得申請精簡審查
新藥審查機制
一般審查
優先審查
標準審查 精簡審查
標準審查 精簡審查
圖
3-3
新藥審查機制



















