
食品管
政策與
藥品管
管制藥
管理
醫療器
化粧品
國家實
檢驗
風險評
及科
國際合
兩岸
風險溝
消費
附
錄
2015 Annual Report
27
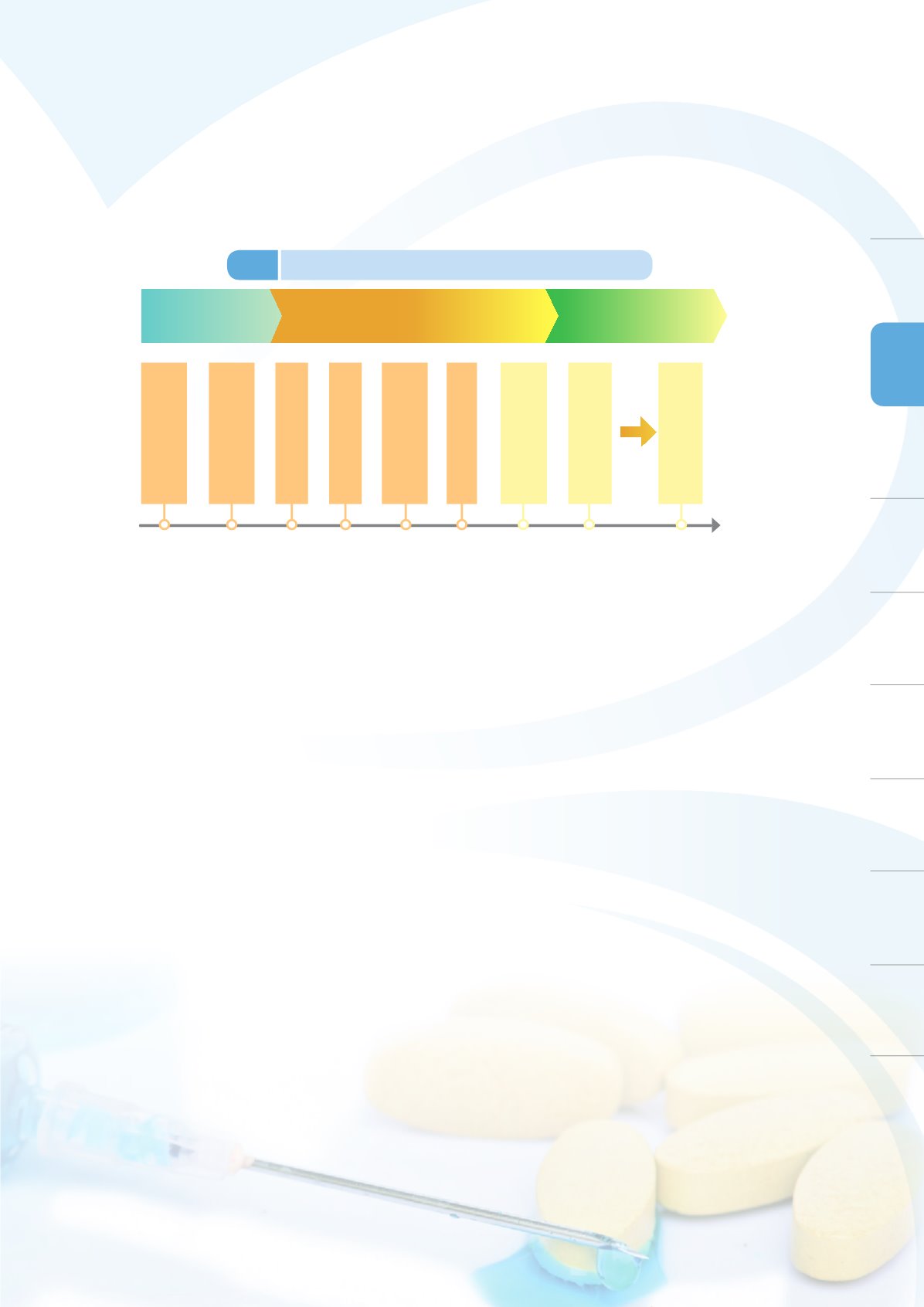
GMP
cGMP(current GMP)
確效作業
PIC/S GMP
衛生署赴日考察
,
草擬
GMP
大綱
公告所有藥品實施
全面確效作業
公告實施
PIC/S GMP
之時程
正式實施
PIC/S GMP
全面完成實施
PIC/S GMP
完成三階段確效作業
發布﹁優良藥品製
造標準﹂
完成實施
GMP
無菌製劑實施確效
民國
66
年
71
年
77
年
84
年
88
年
94
年
96
年
12
月
99
年
1
月
103
年
12
月31日起
綜觀我國藥品
GMP
制度之管理範疇,從西藥製劑廠逐步將藥品物流廠、醫用氣體廠
及原料藥廠等均納入管理,未來將持續推動實施藥品優良運銷規範(
Good Distribution
Practice, GDP
),以涵蓋藥品全供應鏈之品質管理。藉由落實西藥製造廠全面實施
PIC/S
GMP
,提升藥品製造端之品質管理,強化藥廠內外部監督落實藥品源頭管理,讓民眾用藥更
安心。
政策與成果
一、落實西藥藥品製造廠全面實施
PIC/S GMP
(一)
PIC/S GMP
之推行
1.
自
102
年
1
月
1
日起,我國以官方身份,領先日本與韓國,正式成為
PIC/S
組織的會員,
顯見我國藥廠
GMP
法規與管理制度及稽查水準已受國際認可,並於
103
年
12
月
31
日全
面完成西藥製劑工廠實施國際
PIC/S GMP
製藥標準,輸入藥品製造工廠與國內藥廠同
步,全面要求符合
PIC/S GMP
,持續為國人用藥安全把關。
2.
為持續嚴格監督藥品生產作業,除每
2-3
年執行例行性查廠外,對於特殊事件(如檢舉
案、市售品質監測結果不合格及新聞事件等)啟動無預警機動性查廠;以專案管理計
畫,確認廠內是否持續監測藥品品質,並實地赴廠抽取檢品進行品質監測,確保在有
效期限內藥品仍維持應有品質。
圖
3-5
西藥製劑廠實施
GMP
歷程



















