
Food and Drug Administration
26
第二節 藥品源頭管理
現況
為提升藥品製造品質及符合國際標準,我國對藥品製劑廠之管理日趨嚴謹並與國際
接軌,從
71
年推動實施優良藥品製造規範(
GMP
),
84
年實施確效作業(
current Good
Manufacturing Practice, cGMP
),並同步發展符合世界潮流的
cGMP
動態管理模式;
96
年實
施「國際醫藥品稽查協約組織(
Pharmaceutical Inspection Convention and Pharmaceutical
Inspection Co-operation Scheme, PIC/S
)」
GMP
標準,西藥製劑廠於
103
年
12
月
31
日前全面
完成實施國際
PIC/S GMP
製藥標準,開闊全球性市場,使臺灣製藥業水準與國際接軌。我國實
施
GMP
歷程如圖
3-5
。
三、推動藥品專案諮詢輔導
(一)在行政院推動「生技產業起飛行動方案」下,致力強化醫藥產業輔導,針對國內研發
新藥,建立「藥品專案諮詢輔導機制」(圖
3-4
)。
(二)專案諮詢輔導機制以「創新程度」、「貢獻程度」、「早收程度」與「滿足法規程度」等四
項評估指標篩選品項,協助國內廠商達到臨床前進入臨床試驗階段(
First in human
)、
進入下一期臨床試驗、申請藥品查驗登記及取得藥品許可證等里程碑。
(三)自
99
年起截至
103
年底共輔導
33
件專案達到研發里程碑,其中
3
件新藥核准上市,
2
件進入新藥查驗登記申請,
7
件進入第三期臨床試驗,
11
件進入第二期臨床試驗,
4
件
進入第一期臨床試驗。另外,也召開
18
件以上專案之廠商諮詢輔導起始會議,透過與廠
商面對面的溝通,了解產品研發規劃與現況,並提出具體明確建議,加速新藥上市嘉惠
國人及早使用新藥。
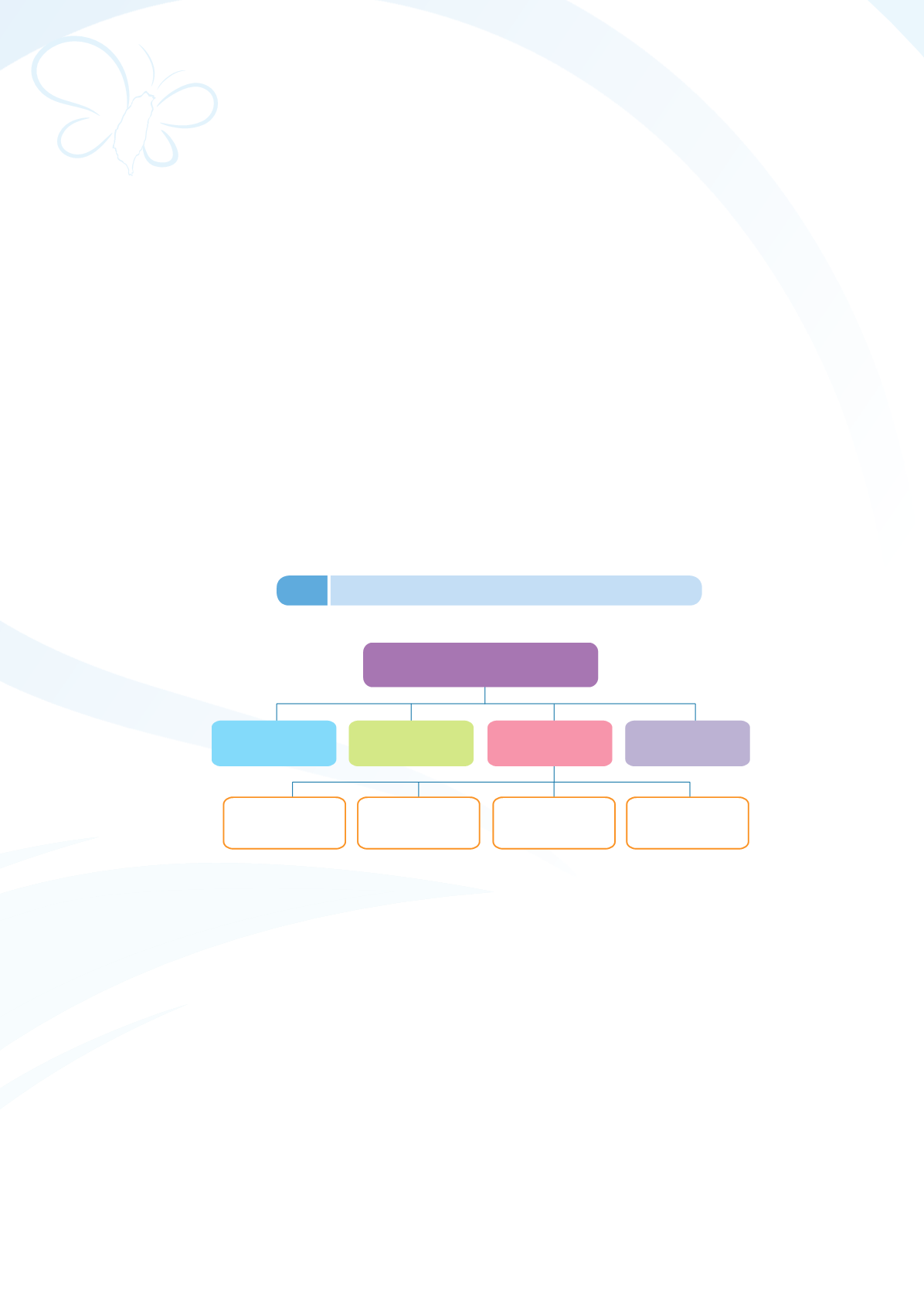
藥品諮詢輔導機制
函詢及諮詢
藥品專案諮詢輔導
(早收清單)
國外登記
(103年科技計畫)
關鍵途徑
國家型
科技發展計畫
線上資訊
及出版品
主動輔導
產業溝通平台
(定期)
圖
3-4
藥品專案諮詢輔導機制



















