Page 58 - 2016食品藥物管理署年報
P. 58
?????????
Taiwan Food and Drug Adminstration
4000
3500 3453
3000
2500
2000
1634
1500 1368 1401
1000 748
500 144 209 375
30 157 54 366 70 85
0
98 99 100 101 102 103 104 (年)
不良反應通報件數 不良品通報件數
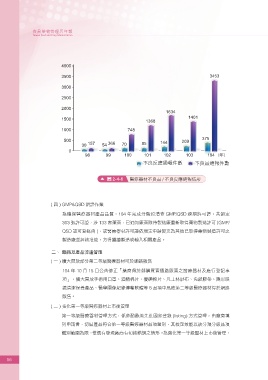
圖 2-4-6 醫療器材不良品 / 不良反應通報情形
( 四 ) GMP&QSD 鎖證作業
為確保醫療器材產品品質,104 年完成分階段清查 GMP/QSD 過期許可證,共鎖定
303 張許可證,涉 133 家藥商,已通知廠商除待製造廠重新取得藥物製造許可 (GMP/
QSD 認可登錄函 ),或醫療器材許可證依規定申請變更為其他已取得藥物製造許可之
製造廠並經核准後,方得繼續製造或輸入相關產品。
二、 藥商及產品流通管理
( 一 ) 擴大開放部分第二等級醫療器材可於網路販售
104 年 10 月 15 日公告修正「藥商得於郵購買賣通路販賣之醫療器材及應行登記事
項」,擴大開放手術用口罩、酒精棉片、優碘棉片、凡士林紗布、免縫膠帶、隱形眼
鏡清潔保養產品、醫學圖像紀錄傳輸軟體等 8 品項中風險第二等級醫療器材得於網路
販售。
( 二 ) 強化第一等級醫療器材上市後管理
第一等級醫療器材管理方式,係參酌歐美先進國家登錄 (listing) 方式管理,由廠商填
列申請書,切結產品符合第一等級醫療器材品項鑑別,其核定效能以該分類分級品項
鑑別範圍為限,惟偶有發現廠商有切結錯誤之情形。為強化第一等級醫材上市後管理,
56