Page 55 - 2016食品藥物管理署年報
P. 55
2016 ANNUAL
REPORT
第二篇
Documentation, QSD),或申請赴海外醫療器材製造廠實地稽查,國產醫療器材製造 重要施政成果
廠則以實地稽查為主。截至 104 年底,有效國產醫療器材 GMP 認可登錄函張數累積
達 685 張,輸入醫療器材 QSD 認可登錄函張數累計達 3,640 張 ( 表 2-4-1)。
醫療器材管理
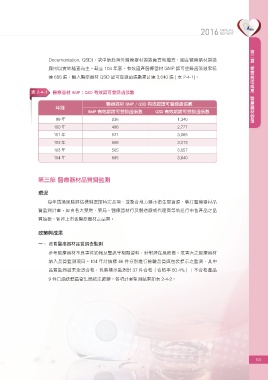
表 2-4-1 醫療器材 GMP / QSD 有效認可登錄函張數
醫療器材 GMP / QSD 有效認證可登錄函張數
年別
GMP 有效認證可登錄函張數 QSD 有效認證可登錄函張數
99 年 236 1,340
100 年 486 2,777
101 年 531 3,065
102 年 568 3,213
103 年 565 3,057
104 年 685 3,640
第三節 醫療器材品質鏈監測
現況
每年透過風險評估機制選擇特定品項,並整合地方縣市衛生局資源,執行醫療器材品
質監測計畫,經由各大藥房、藥局、醫療器材行及製造廠或代理商等地進行市售產品之品
質抽檢,監控上市後醫療器材之品質。
政策與成果
一、 市售醫療器材品質調查監測
參考醫療器材不良事件通報及警訊等相關資料,針對潛在風險高、危害大之醫療器材
納入品質監測項目。104 年計抽樣 46 件分別進行檢驗品質與包裝標示之監測,其中
品質監測結果全數合格,包裝標示監測計 37 件合格(合格率 80.4%);不合格產品
9 件已函送轄區衛生局依法處辦,各項計畫監測結果如表 2-4-2。
53