Page 53 - 2016食品藥物管理署年報
P. 53
2016 ANNUAL
REPORT
第二篇
重要施政成果
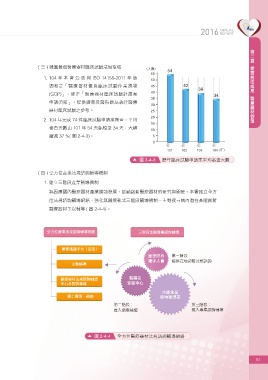
( 三 ) 建置優質醫療器材臨床試驗法規環境 (天數)
55 54
1. 104 年本署公告與 ISO 14155-2011 年版 50
調和之「醫療器材優良臨床試驗作業規範 45 42 38 醫療器材管理
(GCP)」,修正「醫療器材臨床試驗計畫案 40 34
35
申請須知」,提供廠商及醫院做為執行醫療
30
器材臨床試驗之參考。 25
20
2. 104 年完成 74 件臨床試驗申請案審查,平均
15
審查天數由 101 年 54 天縮短至 34 天,大幅 10
縮減 37 %( 圖 2-4-3)。 5
0
101 102 103 104 (年)
圖 2-4-3 歷年臨床試驗申請案平均審查天數
( 四 ) 全方位產業法規諮詢輔導機制
1. 建立三階段產業輔導機制
為因應國內醫療器材產業蓬勃發展,鼓勵創新醫療器材的研究與開發。本署建立全方
位法規諮詢輔導網絡,強化無縫接軌式三階段輔導機制,主動搜尋國內潛在高階創新
醫療器材予以輔導 ( 圖 2-4-4)。
全方位產業法規諮詢輔導網絡 三階段主動產業諮詢輔導
產業溝通平台(定期)
產學研界 第一階段:
種子人員 提供在地初階法規諮詢
主動輔導
醫療器材法規諮詢輔導 醫藥品
中心及諮詢專線 查驗中心
本部食品
線上資源、函詢 藥物管理署
第二階段: 第三階段:
進入個案輔導 進入專案諮詢輔導
圖 2-4-4 全方位醫療器材法規諮詢輔導網絡
51