Page 57 - 2016食品藥物管理署年報
P. 57
2016 ANNUAL
REPORT
第二篇
重要施政成果
醫材不良
反應通報系統
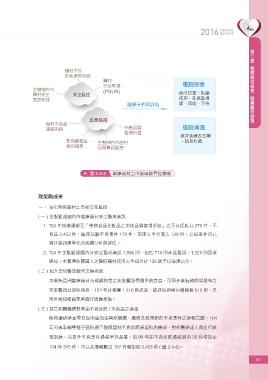
醫材
安全監視 風險控管
主動國內外 (PSUR) 醫療器材管理
醫材安全 安全監控 修訂仿單、限縮
警訊監控 使用、延長監視
風險分析再評估 期、回收、下市
品質監控
醫材不良品
通報系統 市售品質 風險溝通
監測計畫
教育訓練及宣導
製造廠稽查、 主動國內外醫材 、訊息傳遞
聯合稽查 品質警訊監控
圖 2-4-5 醫療器材上市後風險管控機制
政策與成果
一、 強化醫療器材上市後安全監控
( 一 ) 主動監視國內外醫療器材安全警戒資訊
1. 104 年接獲通報至「藥物食品化粧品上市後品質管理系統」之不良反應為 375 件、不
良品 3,453 件、臨床試驗不良事件 178 件、定期安全性報告 138 份,上述案件均已
進行資訊標準化及後續分析與評估。
2. 104 年主動監視國內外安全警戒資訊 1,936 則,包括 715 則產品警訊,1,221 則回收
通知;本署擇攸關國人之醫療器材使用安全訊息計 136 則予以摘譯公告。
( 二 ) 加入全球警訊報告交換系統
本署為亞洲醫療器材法規調和會之安全警訊傳遞系統會員,可同步掌握國際間發布之
安全警訊及回收消息,104 年計接獲 1,416 則訊息,經評估與國內相關者 510 則,已
同步通知相關業者進行因應措施。
( 三 ) 提高相關機構對產品不良反應 / 不良品之通報
除持續透過宣導及說明會加強醫療機構、廠商及民眾對於不良事件之通報意願,104
年另專案輔導種子醫院建置醫療器材不良反應通報院內機制,對相關通報人員進行教
育訓練,以提升不良事件通報量及品質。自 98 年起不良反應通報數由 30 件增加至
104 年 375 件,不良品通報數由 157 件增加到 3,453 件 ( 圖 2-4-6)。
55