Page 34 - 2016食品藥物管理署年報
P. 34
?????????
Taiwan Food and Drug Adminstration
政策與成果
一、 健全法規標準
104 年度藥政管理法規及相關標準重要增修訂,包括修正藥事法及罕見疾病防治及藥
物法部分條文、藥品生體可用率及生體相等性試驗準則、藥害救濟申請辦法、藥品查
驗登記審查準則,訂定藥物回收處理辦法、生物相似性單株抗體藥品查驗登記基準、
人類細胞治療產品捐贈者合適性判定基準及產品查驗登記審查基準,公告藥品仿單應
刊載賦形劑成分名或品名、製劑使用之原料藥應符合藥品優良製造規範,增修訂內容
見附錄一附表十。
二、 藥品查驗登記管理
藥品之查驗登記可分為原料藥及製劑,製劑尚可分新藥、生物製劑、學名藥及罕藥。
申請查驗登記如需檢附國內臨床試驗或生體可用率與生體相等性試驗,且其計畫書及
報告書亦須經過審核。本署每年核准之藥品許可證數量,如附錄一附表十一。
( 一 ) 藥品上市前查驗登記
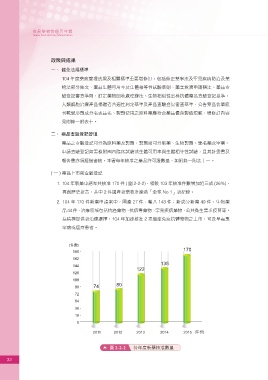
1. 104 年新藥申請案共核准 170 件 ( 圖 2-2-2),相較 103 年核准件數增加近三成 (26%),
再創歷史新高,其中 2 件國產新藥核准締造「全球 No.1」新紀錄。
2. 104 年 170 件新藥申請案中,國產 27 件,輸入 143 件;新成分新藥 49 件、生物藥
品44件,治療領域包括抗癌藥物、抗病毒藥物、罕見疾病藥物、公共衛生需求疫苗等。
為積極提供新治療選擇,104 年加速核准 2 項癌症免疫抗體藥物之上市,可及早嘉惠
罕病或癌症患者。
(件數)
180 170
162
135
144
122
126
108
90 74 80
72
54
36
18
0
2011 2012 2013 2014 2015 (年份)
圖 2-2-2 各年度新藥核准數量
32