Page 37 - 2016食品藥物管理署年報
P. 37
2016 ANNUAL
REPORT
第二篇
2. 為持續嚴格管理藥品生產作業,西藥廠後續追蹤管理包括定期檢查及不定期檢查機 重要施政成果
制,對於特殊事件 ( 如檢舉案、市售品質監測結果不合格及新聞事件等 ) 並啟動無預
警機動性查廠;另啟動主題式查核,進一步確認西藥廠品質管理現況,並現場抽驗及
抽樣送驗以進行品質監測,確保效期內藥品維持應有品質。
藥品管理
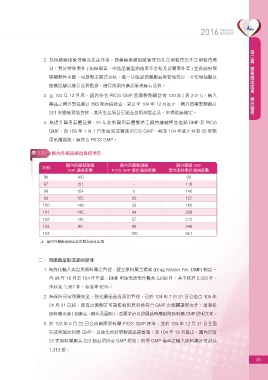
3. 至 104 年 12 月底,國內符合 PIC/S GMP 西藥製劑廠計有 120 家 ( 表 2-2-1),輸入
藥品之國外製造廠計 893 家通過檢查,累計至 104 年 12 月底止,國外西藥製劑廠計
251 家通過實地查核,其所生產項目已涵蓋各類劑型產品,市場供應穩定。
4. 為提升醫用氣體品質,91 年起對醫用氣體製造工廠持續輔導並推動 GMP 及 PIC/S
GMP,自 103 年 1 月 1 日全面完成實施 PIC/S GMP,截至 104 年底止共有 33 家醫
用氣體製造工廠符合 PIC/S GMP。
表 2-2-1 國內外藥廠通過查核情形
國內西藥製劑廠 國內西藥製劑廠 國外藥廠 GMP
年別
GMP 通過家數 PIC/S GMP 累計通過家數 實地查核累計通過家數
96 160 - 93
97 151 - 118
98 154 5 140
99 155 22 157
100 149 33 180
101 145 44 209
102 140 57 213
103 98 98 246
104 - 120 251
註 : 國內外藥廠通過查核家數為逐年累加
二、 西藥藥品製造源頭管理
1. 為強化輸入與自用原料藥之管理,建立原料藥主檔案 (Drug Master File, DMF) 制度。
自 98 年 10 月至 104 年年底,DMF 申請案結案件數共 3,690 件,其中核准 2,323 件,
未核准 1,367 件,核准率 63%。
2. 為保障民眾用藥安全,強化藥品品質源頭管理,已於 104 年 7 月 31 日公告自 105 年
01 月 01 日起,既有之製劑許可證應檢附原料藥符合 GMP 之相關證明文件,並登錄
原料藥來源 ( 含廠名、廠址及國別 ),並要求許可證展延時應檢附原料藥 GMP 證明文件。
3. 於 102 年 5 月 22 日公告國際原料藥 PIC/S GMP 標準,並於 104 年 12 月 31 日全面
完成實施原料藥 GMP,以強化原料藥製造品質管理;至 104 年 12 月底止,國內已有
21 家原料藥廠共 223 個品項符合 GMP 規定;取得 GMP 備查之輸入原料藥許可證共
1,313 張。
35