
Food and Drug Administration
50
(二)加入全球警訊報告交換系統
本署為國際醫療器材法規官方論壇(
International Medical Device Regulators Forum,
IMDRF
)「主管機關警訊報告交換系統」(
National Competent Authority Report exchange
program, NCAR
)之會員,可同步掌握各會員國回收通知及安全警訊,
103
年接獲全球
警訊報告計
331
件,而經分析與國內相關者有
93
件,亦已同步通知相關業者進行因應
措施。
(三)提高相關機構對產品不良反應
/
不良品之通報
持續透過宣導及說明會,鼓勵醫療機構、廠商及民眾,藉由全國藥物不良反應
/
不良品
通報系統通報產品不良事件,以偵測醫療器材產品上市後之品質及安全訊息,執行風險
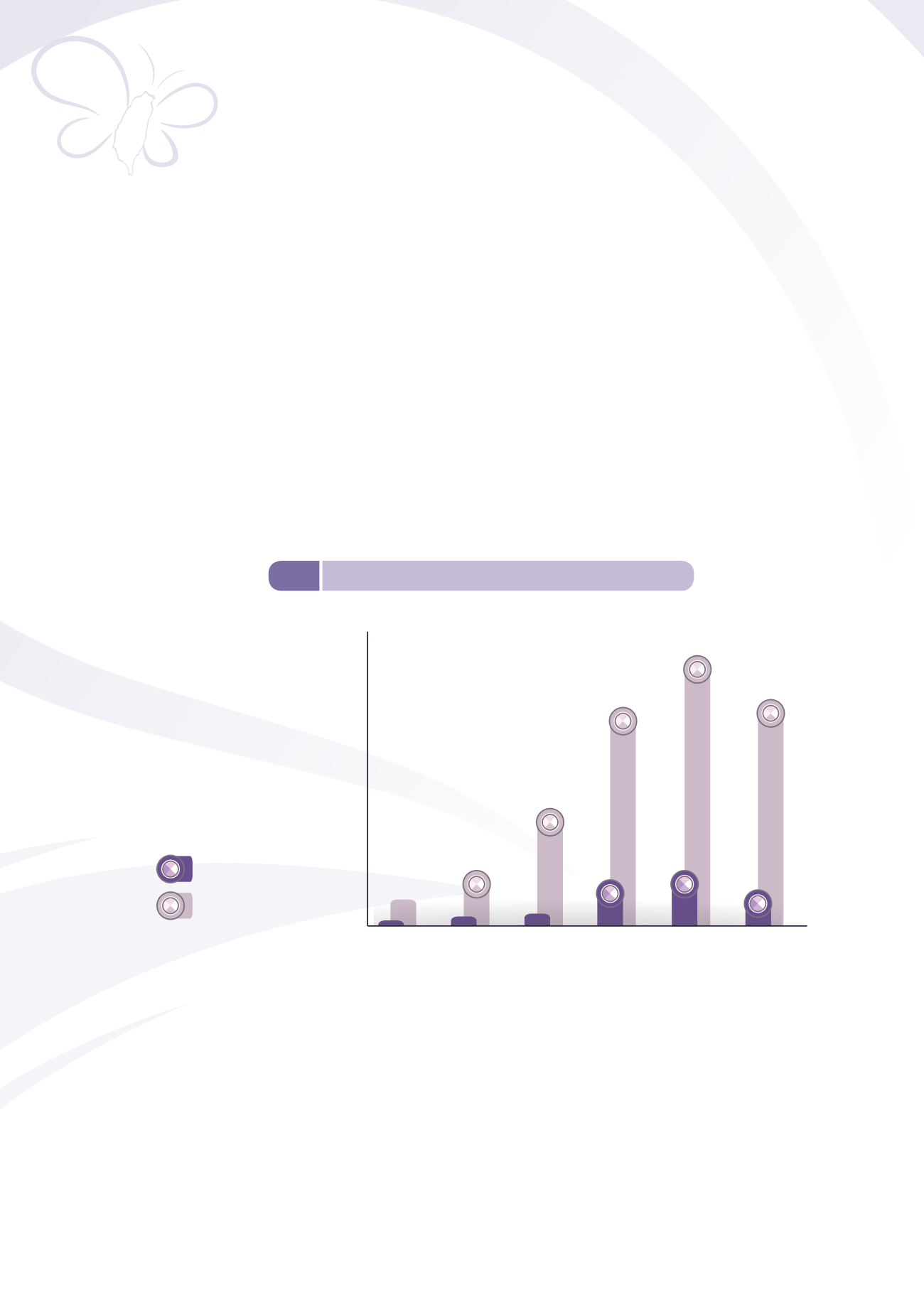
管理措施。通報件數自
98
年起,不良反應通報數由
30
件增加至
103
年
209
件,不良品
通報數由
157
件增加到
1,401
件(圖
5-5
)。
二、藥商及產品流通管理
(一)第一等級及部分第二等級醫療器材開放網路販售
為保障民眾使用醫療器材之安全及兼顧醫療器材取得之便利性,本署於
101
年
11
月
1
日公告「藥商得於郵購買賣通路販賣之醫療器材及應行登記事項」,開放第一等級低風
險醫療器材,明訂販賣業者須領有醫療器材販賣業藥商許可執照,且具有實體通路營業
處所,並向轄區衛生局申請,經核准後得於網站、電視頻道等郵購買賣通路販售。並於
103
年
1
月
2
日公告適合居家使用的衛生套、衛生棉條及體脂計等
3
項第二等級醫療器
材可於網路販售。另規定藥商須於郵購買賣通路上載明,使用前應詳閱產品說明書,具
98
年
157
366
748
1368
1634
1401
99
年
100
年
101
年
不良品反應通報件數
不良品通報件數
102
年
103
年
30
54
70
285
372
209
200
0
400
600
800
1000
1200
1400
1600
1800
圖
5-5
醫療器材不良品/不良反應通報情形



















