Page 51 - 2016食品藥物管理署年報
P. 51
2016 ANNUAL
REPORT
第二篇
第四章 醫療器材管理 重要施政成果
隨著科技日新月異發展、醫療保健科技化需求,邁入老年化社會,醫療器材產業成為
我國最具潛力生技產業。面對國內醫療器材產業的活絡,本署從法規管理國際化、生產源
頭控管、上市前把關、上市後監督、藥商及產品流通管理及專業諮詢輔導,建立醫療器材 醫療器材管理
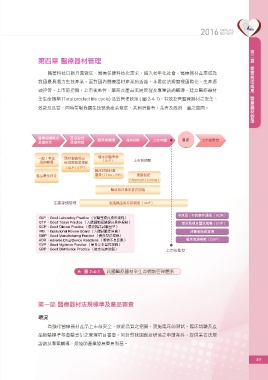
全生命週期 (Total product life cycle) 品質管理政策 ( 圖 2-4-1),有效控管醫療器材之安全、
效能及品質,同時帶動我國生技醫藥產業發展,共創消費者、業者及政府三贏之局面。
醫療照護需求 產品設計 臨床前驗證 臨床試驗 上市申請 量產 上市後監控
基礎研究 原型開發
臨床試驗查核
一般 / 專案 醫材查驗登記 上市前把關
諮詢輔導 檢測實驗室規範 (GCP)
(GLP / GTP)
臨床試驗計畫
產品屬性判定 審查 (TFDA / IRB) 查驗登記
(Approval / Listing)
醫療器材專家委員諮議
生產源頭管理 製造廠品質系統稽查 (GMP)
不良品 / 不良事件通報 (ADR)
GLP :Good Laboratory Practice (實驗室優良操作規範)
GTP:Good Tissue Practice (人體細胞組織優良操作規範) 安全監視及警訊蒐集(GVP)
GCP:Good Clinical Practice (優良臨床試驗基準)
IRB :Institutional Review Board (人體試驗委員會) 消費者衛教宣導
GMP:Good Manufacturing Practice (優良製造規範)
ADR:Adverse Drug/Device Reactions (藥物不良反應) 優良流通規範(GDP)
GVP:Good Vigilance Practice (優良安全監控規範)
GDP:Good Distribution Practice (優良流通規範)
上市後監控
圖 2-4-1 我國醫療器材全生命週期管理體系
第一節 醫療器材法規標準及產品審查
現況
為強化醫療器材產品上市前安全、效能品質之把關,實施臨床前測試、臨床試驗及產
品檢驗標準等查驗登記之管理項目審查。另針對我國創新研發之申請案件,提供業者法規
諮詢及專案輔導,是協助產業發展重要利基。
49