Page 127 - 2018食藥署年報(中文版)
P. 127
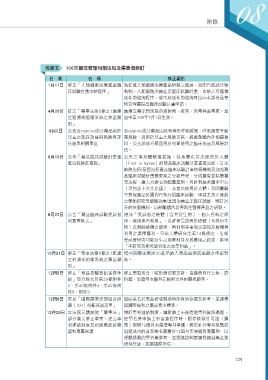
附表五 106年藥政管理相關法規及標準增修訂
日 期 名 稱 修正重點
1月17日 修正「人類細胞治療產品臨 為促進人類細胞治療產品研發之進展,自即日起試行雙
床試驗計畫申請程序」 軌制,人類細胞治療產品臨床試驗計畫,申請人可選擇
送件前諮詢程序,或不經送件前諮詢直接向本部食品藥
物管理署提出臨床試驗計畫申請。
4月20日 訂定「藥事法第6條之1應建 應建立藥品類別為血液製劑、疫苗、肉毒桿菌毒素。並
立追溯或追蹤系統之藥品類 自中華106年7月1日生效。
別」
8月2日 公告含codeine成分藥品用於 含codeine成分藥品因具有導致呼吸緩慢、呼吸困難等嚴
兒童之臨床效益與風險再評 重風險,且用於兒童之風險更高,經彙整國內外相關資
估結果相關事宜 料,公告該成分藥品用於兒童使用之臨床效益及風險評
估。
8月10日 公告「藥品臨床試驗計畫審 公告三項具體精進措施,包括簡化首次使用於人體
查流程精進措施」 (First in human)的藥品臨床試驗計畫審查流程、訂定
細胞治療/基因治療產品臨床試驗計畫快審機制及加強藥
品臨床試驗計畫變更案之分級管理,分流審查並精簡審
查流程,讓人力做有效配置運用。另針對屬多國多中心
(須包含十大先進國)、非首次使用於人體,及同實驗
室製程產品於國內已執行過臨床試驗、申請主持人發起
之學術研究用細胞治療/基因治療產品臨床試驗,增訂30
天的快審機制,以鼓勵國內新興再生醫療產品之研發。
8月22日 公告「藥品臨床試驗受試者 增加「受試者之檢體(含其衍生物)、個人資料之保
同意書格式」 存、使用與再利用」,以確保受試者於檢體(含其衍生
物)及剩餘檢體之使用、再利用等事項之認知及檢體再
利用之選擇權利。另依人體研究法第14條規定,告知
受試者研究可能衍生之商業利益及其應用之約定,新增
「本研究預期可能衍生之商業利益」。
10月31日 修正「藥事法第6條之1應建 增列高關注類別30品項納入藥品追溯或追蹤之申報對
立追溯或追蹤系統之藥品類 象。
別」
12月5日 修正「藥品查驗登記審查準 修正重點包含:賦形劑仿單更新,由廠商自行上傳;原
則」部分條文及第39條附件 料藥、新藥等查驗登記檢附文件相關規範等。
2、第40條附件4、第42條附
件8、附件9
12月6日 更新「國際醫藥法規協合組 協助業者於藥品研發製造時能有所依循及參考,並建構
織(ICH)規範採認清單」 與國際協和之藥品審查標準。
12月29日 立法院三讀通過「藥事法」 增訂專利連結制度,讓新藥上市後透過專利資訊揭露,
部分條文修正草案,建立專 使學名藥申請上市審查程序時,暫停核發許可證(續
利連結制度及新適應症新藥 審)期間12個月來釐清專利爭議,對於進行專利挑戰或
資料專屬保護 迴避成功的首家學名藥獲得12個月市場銷售專屬期,以
獎勵挑戰的學名藥業者,並透過該制度讓我國製藥產業
研發升級,拓展國際市場。
125