Page 16 - 2023食品藥物管理署年報(中文版)
P. 16
2023
食品藥物管理署年報
第四節
藥品及管制藥品管理總論
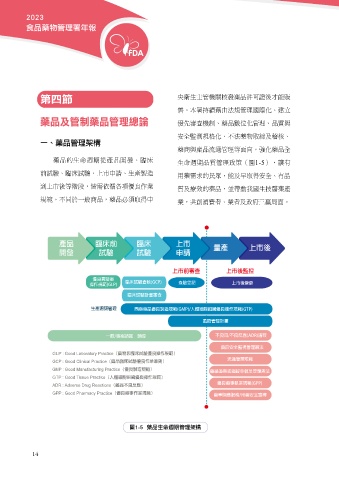
一、藥品管理架構
1-5
產品 臨床前 臨床 上市 量產 上市後
開發 試驗 試驗 申請
優良實驗室 臨床試驗查核(GCP) 上市前審查 上市後監控
操作規範(GLP) 臨床試驗計畫審查
查驗登記 上市後變更
生產源頭管理 西藥藥品優良製造規範(GMP)/人體細胞組織優良操作規範(GTP)
風險管理計畫
一般/專案諮詢 輔導 不良品/不良反應(ADR)通報
藥品安全監視管理辦法
GLP : Good Laboratory Practice(藥物非臨床試驗優良操作規範) 流通管理規範
GCP : Good Clinical Practice(藥品臨床試驗優良作業準則)
GMP : Good Manufacturing Practice(優良製造規範) 藥品追溯或追蹤申報及管理辦法
GTP : Good Tissue Practice(人體細胞組織優良操作規範) 優良藥事執業規範(GPP)
ADR : Adverse Drug Reactions(藥品不良反應)
GPP : Good Pharmacy Practice(優良藥事作業規範) 藥事照護服務/用藥安全宣導
圖1-5 藥品生命週期管理架構
14