我國公告實施通用技術文件(CTD)格式
為順應世界潮流,與國際接軌,並加速藥品查驗登記審查作業,本局茲參考國際醫藥法規協合組織(International Conference on Harmonisation, ICH)之Common Technical Document(CTD) format,訂定「通用技術文件(CTD)格式」,並於101年7月24日署授食字第1011405725號公告。
廠商申請藥品查驗登記時,除依藥品查驗登記審查準則及相關規定檢附資料向本局提出申請外,其所檢附資料應依「通用技術文件格式」呈現。若申請案件時未依附件格式檢送或內容嚴重缺失,得視情況退件退費。
自101年11月1日起,新成分新藥查驗登記申請須依「通用技術文件格式」公告辦理;原料藥查驗登記(署授食字第1021400426號)自102年7月1日起實施;新成分以外新藥查驗登記(部授食字第1021453148號)、學名藥查驗登記(部授食字第1021452529號)則自103年7月1日起施行。
通用技術文件(CTD)格式送件的優點
1. 促進我國藥品查驗登記審查作業與國際協合化
2. 促進國內製藥產業發展,與國際接軌
3. 加速我國藥品審查作業
● 能快速定位取得審查所需文件
● 促進本局、廠商間溝通
● 促進審查一致性
4. 有助廠商準備資料送件,減少花費經費、人力及時間進行資料重整與編寫
何謂通用技術文件(CTD)格式?
國際醫藥法規協合組織(International Conference on Harmonisation, ICH)訂定「通用技術文件(Common Technical Document, CTD)」,以規範藥品查驗登記送審資料能以統一的格式來呈現,以達到:
● 促進國際間醫藥品查驗登記審查作業協合化
● 加速各國藥品查驗登記審查作業
● 有利藥廠準備資料向各國送件,減少花費經費、人力及時間
● 促進藥品審查核准上市,使病人及早使用新藥
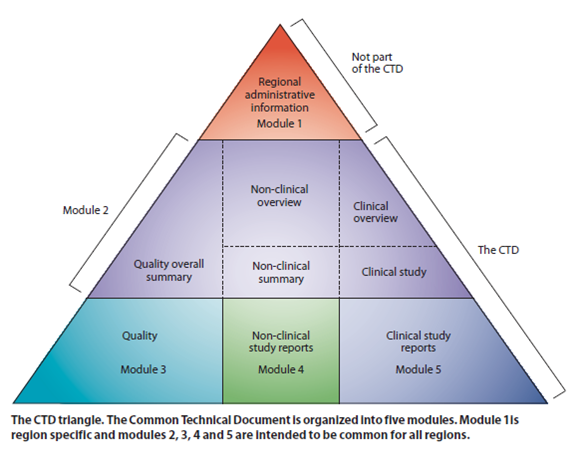
CTD格式共由五個模組(Module1~5)組成,模組1依不同地區而異,模組2、3、4 和5 在各個ICH地區是統一的,如下表:
| 模組 |
內容敘述 |
| 模組 1 地區性行政資料(Regional Administrative Information ) |
各地區之行政資料要求。 |
| 模組 2 通用技術文件摘要(Summaries) |
藥品品質、非臨床和臨床資料之摘要。 |
| 模組 3 品質(Quality) |
藥品原料藥、成品之化學製造管制(CMC)的資料。 |
| 模組 4 非臨床試驗報告(Non-cinical Study Reports) |
藥品藥理學、毒理學試驗的資料。 |
| 模組 5 臨床試驗報告(Cinical Study Reports) |
藥品臨床試驗、人體藥動藥效學試驗的資料。 |
CTD架構如下圖:
諮詢窗口
1.通用技術文件(CTD)格式相關問題,請至CDE網站>廠商專區>諮詢輔導申請服務,線上填寫藥品諮詢服務申請表。
2.CTD相關問題(Q&A)。