醫療器材臨床試驗嚴重不良事件通報
| 發布日期:2015-01-20 | 更新日期:2022-07-15
發布單位:醫療器材及化粧品組
|

|
| 我要通報 (另開視窗) |
| 為確保受試者權益,並提升國內臨床試驗之水準,醫療機構及試驗委託者獲知嚴重不良事件時應於法定期限內通報主管機關。 |
| 一、法規: |
藥事法
第45-1條 醫療機構、藥局及藥商對於因藥物所引起之嚴重不良反應,應行通報;其方式、內容及其他應遵行事項之辦法,由中央衛生主管機關定之。 |
| 嚴重藥物不良反應通報辦法 |
| 第2條 |
本辦法所稱之藥物係指藥事法第四條所稱之藥物 (藥品與醫療器材)。 |
| 第3條 |
因藥物所引起之嚴重藥物不良反應發生時,醫療機構、藥局、藥商應依本辦法填具通報書,連同相關資料,向中央衛生主管機關或其委託機構通報。 |
| 第4條 |
本辦法所稱之嚴重藥物不良反應,係指因使用藥物致生下列各款情形之一者:
一、死亡。
二、危及生命。
三、造成永久性殘疾。
四、胎嬰兒先天性畸形。
五、導致病人住院或延長病人住院時間。
六、其他可能導致永久性傷害需做處置者。 |
| 第5條 |
醫療機構及藥局應於得知前條第一款及第二款之嚴重藥物不良反應之日起七日內,依第三條規定辦理通報,並副知持有藥物許可證之藥商。 |
| 第6條 |
持有藥物許可證之藥商於得知嚴重藥物不良反應之日起十五日內,依第三條規定辦理通報。 |
| 人體試驗管理辦法 |
| 第12條 |
受試者於人體試驗施行期間發生下列情事,或任何時間發生與人體試驗有關之下列情事時,醫療機構應通報中央主管機關: |
| |
一、死亡 |
| |
二、危及生命 |
| |
三、永久性身心障礙 |
| |
四、受試者之胎兒或新生兒先天性畸形 |
| |
五、需住院或延長住院之併發症 |
| |
六、其他可能導致永久性傷害之併發症 |
| |
前項通報應於得知事實後7日內為之,並於15日內檢具詳細調查資料送中央主管機關。 |
| 醫療器材優良臨床試驗基準 |
| 第106條 |
受試者發生任何嚴重不良事件,試驗主持人應立即通知試驗委託者,並儘快提供詳細書面報告。發生未預期之嚴重不良事件,試驗主持人應立即通知人體試驗委員會及主管機關。 |
| |
試驗委託者獲知死亡或危及生命之嚴重不良事件,應於獲知日起7日內通報主管機關或其委託機構,並在獲知日起15日內提供詳細書面資料。 |
| |
試驗委託者獲知死亡或危及生命以外之嚴重不良事件,應於獲知日起15日內通報主管機關或其委託機構,並提供詳細書面資料。 |
| |
第一項之口頭及書面報告,應以受試者代碼代表受試者之身分,不得顯示受試者之姓名、身分證字號、住址或其他可辨認受試者身分之資訊。 |
| |
嚴重不良事件之項目由主管機關公告之。 |
| 醫療器材優良臨床試驗作業規範 |
| 五十六 |
嚴重不良事件及可能導致嚴重醫療器材不良反應之醫療器材缺失,試驗委託者應於得知事實後七日內通報主管機關,並於十五日內檢具詳細調查資料送至主管機關。 |
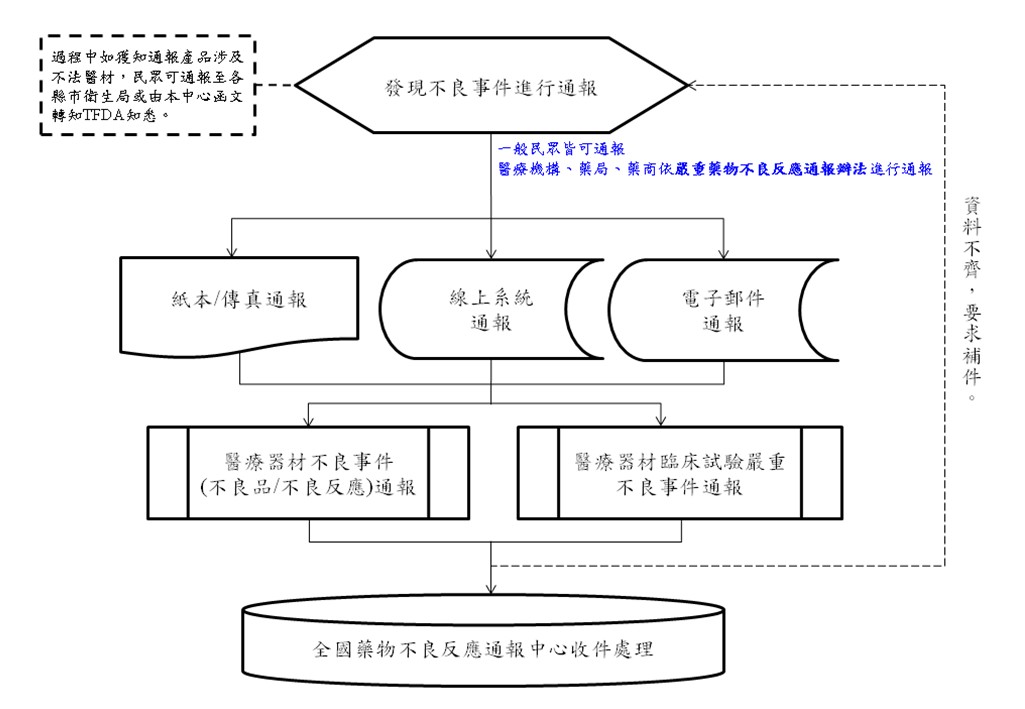
| 二、作業流程: |
| (一) |
醫療器材於臨床試驗發生之嚴重不良事件,請填具公告之醫療器材臨床試驗嚴重不良事件(SAE)通報表,以線上通報、傳真、郵寄或電子郵件( mdsafety@fda.gov.tw)通報的方式通報至全國藥物不良反應通報中心(地址:10092台北市中正區愛國東路22號10樓)。 |
| (二) |
全國藥物不良反應通報中心於收到通報資料時,依標準作業程序進行個案之編碼及建檔。通報者若為確保本中心已收到該通報資料,可隨通報資料一同附上「上市後通報回函」,本中心收到回函後,將以電子郵件或傳真方式回覆通報者。 |
| (三) |
案件完成建檔後,將由全國藥物不良反應通報中心依照通報案件評估作業標準對案件進行評估作業,評估內容包含通報資料完整性、風險等級及成因相關性等。 |
| (四) |
若發現有填寫不清或疑問處,將以電子郵件或致電通報者詢問。 |
| (五) |
完成評估之案例,其評估資料可做為分析統計、撰寫藥物安全議題相關文章以及提報食品藥物管理署做為藥物安全性再評估及風險管控之用。 |
| 基本流程如下圖所示: |
 |