申請醫療器材優良製造規範流程及表單下載
| 發布日期:2010-09-17 | 更新日期:2019-01-29
發布單位:醫療器材及化粧品組
|
申請醫療器材優良製造規範流程及表單下載
- 根據藥事法 (另開視窗)第五十七條,製造藥物(指藥品及醫療器材),應由藥物製造工廠為之;藥物製造工廠,應依藥物製造工廠設廠標準(另開視窗)設立,並依工廠管理輔導法規定,辦理工廠登記。但依工廠管理輔導法規定免辦理工廠登記,或經中央衛生主管機關核准為研發而製造者,不在此限。
藥物製造,其廠房設施、設備、組織與人事、生產、品質管制、儲存、運銷、客戶申訴及其他應遵行事項,應符合藥物優良製造準則(另開視窗)之規定,並經中央衛生主管機關檢查合格,取得藥物製造許可後,始得製造。但經中央衛生主管機關公告無需符合藥物優良製造準則之醫療器材製造業者,不在此限。
- 無需申請醫療器材優良製造規範之品項,請參照醫療器材管理辦法(另開視窗)附件二。」。(自103年3月11日起,第一等級列屬「醫療器材管理辦法附件二」未滅菌或不具量測功能品項之醫療器材,其製造業者,須符合GMP(「藥物優良製造準則」第三編:第三章 精要模式)相關規定。)
- 有關藥物製造業者之實施檢查及申請檢查,依藥事法第七十一條第三項規定訂定藥物製造業者檢查辦法(另開視窗)。
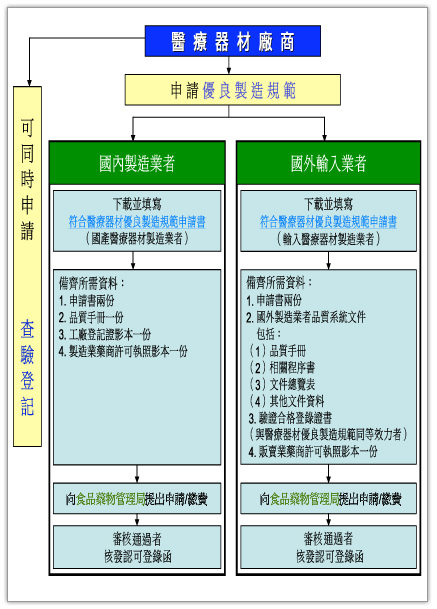
- 申請醫療器材優良製造規範流程圖文字說明:
◎ 國內製造業者:
1.下載並填寫「符合醫療器材優良製造規範申請書(國產醫療器材製造業者)」;
2.備其所需資料:
(1)申請書二份
(2)品質手冊一份
(3)工廠登記證影本一份
(4)製造業藥商許可執照影本一份
3.向食品藥物管理署提出申請/繳費;
4.經審核通過者,核發認可登錄函。 ◎ 國外輸入業者:
1.下載並填寫「符合醫療器材優良製造規範申請書(國外醫療器材製造業者)」;
2.備其所需資料:
(1)申請書二份
(2)國外製造業者品質系統文件,包括:
 品質手冊 品質手冊
 相關程序書 相關程序書
 文件總覽表 文件總覽表
 其他文件資料 其他文件資料
(3)驗證合格登錄證書(與醫療器材優良製造規範同等效力者)
(4)販賣業藥商許可執照影本一份
3.向食品藥物管理署提出申請/繳費;
4.經審核通過者,核發認可登錄函。
申請優良製造規範的同時,可同時送醫療器材查驗登記申請,以取得醫療器材許可證。
|
 |